Virusonderzoek en -diagnostiek in high-containment unit gebaat bij multifunctionele bioreader

PhD-onderzoeker Luca Bordes maakt bij WBVR veelvuldig gebruik van de door BioSPX geleverde Cytation 1 reader. Door de combinatie met de BioStack, die je met maximaal 30 microtiterplaten kunt vullen, kan hij flink productie draaien.
Twee jaar geleden heeft Wageningen Bioveterinary Research (WBVR) in Lelystad geïnvesteerd in een Cytation 1 cell-imaging multimode reader van Agilent. In eerste instantie voor diagnostiek om het uitlezen van de bewerkelijke virusneutralisatietests (VNT’s) te automatiseren. Maar ook de onderzoekers in de high-containment unit weten het apparaat te vinden. Luca Bordes, PhD-onderzoeker bij virologie, gebruikt het apparaat bij de ontwikkeling van een methode om te herkennen wanneer bepaalde stammen van het vogelgriepvirus gevaarlijker of minder gevaarlijk worden voor bepaalde diersoorten.

Wanneer je op bezoek gaat bij de high-containment unit (HCU) van Wageningen Bioveterinary Research (WBVR) in Lelystad hoef je thuis niet uren voor de kledingkast te staan om te bedenken wat je die dag eens aan zal trekken. Voordat je de ruimte, die vanwege veterinaire biosafety level 2 (BSL2) continu onder een onderdruk wordt gehouden, mag betreden moet je je namelijk helemaal uitkleden en mag je verder in een niet al te modische creatie van witte broek en (naar keuze) witte trui of wit t-shirt. En verder moet alles, behalve je bril, achterblijven in een locker.

De Cytation 1 reader met BioStack stapelaar staat in een aparte ruimte, zodat virologie en bacteriologie, van zowel onderzoek als diagnostiek, van deze opstelling gebruik kunnen maken.
Veilig en comfortabel werken
Eenmaal door de luchtsluis is het lichte ongemak, dat zo’n strenge procedure bij een eerste bezoek toch wel met zich meebrengt, als sneeuw voor de zon verdwenen. In de HCU heb je namelijk onverwacht veel bewegingsruimte zonder dat er extra bescherming nodig is. “Het BSL-2-regime voor het hele gebouw is voor ons heel comfortabel werken. Je kunt je vrij bewegen tussen technische dienst, kantine, opslag met vriezers, kantoren en de meeste labs. Alleen voor de laboratoria met een strenger regime moet je aanvullende beschermingsmaatregelen nemen, en ook een extra luchtsluis door. We kunnen wat dat betreft tot humaan BSL3 en veterinair BSL4. Zo hebben we bij virologie voor bijvoorbeeld vogelgriep, SARS-CoV-2, rabiës en andere zoönosen een apart BSL3 lab ingericht; bij bacteriologie zijn er soortgelijke faciliteiten voor bijvoorbeeld Brucella, Anthrax en Q-koorts”, vertelt Mirriam Tacken, projectleider virologie bij zowel onderzoek als diagnostiek. “Dat neemt overigens niet weg dat voor de hele HCU geldt dat alle lucht wordt gefilterd en alles wat naar buiten gaat steriel moet zijn. Dat geldt niet alleen voor het laboratoriumafval. Ook bijvoorbeeld het spoelwater na een toiletbezoek en de verplichte douche van minstens vijf minuten als je de unit verlaat, wordt geautoclaveerd.”

Mirriam Tacken, projectleider virologie, in het BSL 2 virologielaboratorium van diagnostiek bij een van de microscopen waar nu nog handmatig virusneutralisatietests (VNT’s) worden uitgelezen.
Uitdagende dubbelfunctie
Mirriam werkt al bijna 20 jaar als post-doc onderzoeker bij de afdeling virologie. Sinds 2020 op iets meer afstand van de labtafel, in de hoedanigheid van projectleider virologie. In die periode startte Mirriam namelijk ook met een 0,5 fte functie binnen de diagnostiek, ook als projectleider in de virologie. “Combinatie van deze functies op 50/50-basis vormde voor mij de ideale constructie om kennis te maken met de veelzijdige afdeling diagnostiek en crisisorganisatie (DCO) zonder afscheid te hoeven nemen van het onderzoek. Ik heb wel gemerkt dat het lastig is om 50/50 te draaien, want ik word vanwege de actualiteit regelmatig de diagnostiek ingezogen. Er spelen vaak ad-hoc zaken, waarbij op dezelfde dag testuitslagen moeten worden gerapporteerd of prangende vragen moeten worden beantwoord richting de klanten. Die dynamiek en het samenwerken binnen een groot team maken dit werk wel erg leuk en afwisselend.”
Corona
Wat die dynamiek betreft, viel Mirriam al snel met de neus in de boter. “In maart 2020 brak covid uit en er was in het begin een serieus gebrek aan testcapaciteit. Met onze 24/7 crisisorganisatie hebben we hier een geoliede machine, die van de ene op de andere dag een veterinaire uitbraak aankan. Onze diagnostiek is zodanig ingericht dat we de dagelijkse monsterstroom op dezelfde wijze uitvoeren als wanneer er een crisis zou zijn. Hierdoor konden we in dit uitzonderlijke geval van een humane uitbraak direct volop meedraaien, onder andere met een zelf opgezette PCR. Een wat dat betreft gunstig bijeffect van de coronacrisis was dat de export van dieren sterk terugliep, waardoor we minder veterinaire monsters draaiden dan normaal. Door de vrijgekomen testcapaciteit konden we direct significant opschalen. Daarbij hadden we geen last van het gebrek aan de lysisbuffer van Roche, waar in die begintijd de hele wereld om verlegen zat. Wij hebben verschillende robotplatforms, waaronder KingFisher, waar wel voldoende materiaal voor beschikbaar was.”
“Eind 2020 zijn we met de humane coronadiagnositiek gestopt in verband met een Aviaire influenza uitbraak in Nederland. Dat begon met serieuze verdenkingen, waarbij het in Lelystad alle hens aan dek was om door adequate monitoring de impact van een infectie op omliggende boerderijen zo klein mogelijk te houden. We rolden van de ene uitbraak in de andere. Na corona en vogelgriep volgde een uitbraak van het blauwtongvirus (BTV). Er volgden vele besmettingen bij schapen, runderen en andere herkauwers met BTV, waar ook in het kader van exportvergunningen momenteel nog steeds ontzettend veel monsters worden geanalyseerd.”
Als we op het lab een positieve uitslag zien, dan willen we die bevestigen met het originele monster uit het originele buisje.
Nationaal referentielab
Voor de overheid is WBVR het nationale referentie-instituut op het gebied van besmettelijke meldingsplichtige dierziekten. Daarmee is WBVR verantwoordelijk voor de uitvoering van diagnostiek in het kader van verdenkingen, uitbraken en monitoringsporgramma’s, en certificeringsdiagnostiek voor export. Dit brengt uiteraard een strak kwaliteitsregime met zich mee. Mede hiervoor is de diagnostiek strikt gescheiden in twee, met elkaar verbonden gebouwen, die beide vallen onder de HCU.
In de dispatching unit (DSU) komen de monsters binnen, waar ze worden uitgepakt, geregistreerd in een LIMS en uitgepipetteerd voor de betreffende analyse, bijvoorbeeld 200 µl voor PCR. Het afgevulde epje gaat gestickerd en wel naar het lab; de rest van het monster wordt in de DSU bewaard. Op deze manier blijft het oorspronkelijke inzendmateriaal te allen tijde in zijn originele staat bewaard, en vrij van eventuele contaminaties of verwisselingen. “Als we op het lab een positieve uitslag zien, dan willen we die bevestigen met het originele monster uit het originele buisje. Bij vogelgriep kan één positief dier namelijk al verregaande consequenties hebben, denk aan dat een heel bedrijf geruimd moet worden of op slot moet en de hele export stilvalt. Dan wil je absoluut zeker zijn van de uitslag en testen we dus nogmaals een monster uit het oorspronkelijke monsterbuisje dat nog niet eerder op het lab is geweest. Pas als die eenzelfde uitslag geeft, gaat het resultaat naar de opdrachtgever. Dit is onze gebruikelijke procedure, die we ook hanteren voor bijvoorbeeld een regulier exportcertificaat van dieren”, aldus Mirriam.
Gouden standaard
De 65 medewerkers bij diagnostiek voeren jaarlijks zo’n 300.000 testen uit. Veel van dat testwerk is op basis van grotendeels geautomatiseerde PCR-analyse. Maar met name voor exportcertificaten zijn nog klassieke serologische methoden vereist. Zo’n gouden standaard is de virusneutralisatietest (VNT).
“Die VNT is best wel bewerkelijk”, legt Mirriam uit. “Als een dier een bepaalde ziekte onder de leden heeft, of heeft gehad, heeft het antilichamen tegen het betreffende virus in het bloed. We halen serum uit dit bloed en maken van dit serum een tienvoudige verdunningsreeks in epjes. Onverdund, 1 op 10, 1 op 100, totdat er bijna geen serum meer in zit. Bij al die epjes voegen we een gelijke hoeveelheid virus toe. Afhankelijk van de hoeveelheid antilichaam zal er meer of minder vrij virus in het epje blijven. Bij veel antilichamen (dus een (doorgemaakte) infectie) wordt al het virus weggevangen. Als je heel weinig of geen antilichamen hebt, dan blijft er virus in het serum zitten. Uit elk van de epjes brengen we vervolgens wat van dat mengsel op cellen waar dat virus goed op kan groeien. Onder de microscoop kan je dan de reeks analyseren. Zie je over de hele verdunningsreeks virus, dan heeft er geen antilichaam in het bloed gezeten. Is dat wel het geval, dan zie je een oplopende reeks aan de hand waarvan je een soort van titer kunt bepalen: er heeft zoveel antilichaam ingezeten.”
Is het maken van de reeks al een flinke klus, het aflezen onder de microscoop vergt ook veel tijd, alleen al door het voorgeschreven ‘vier-ogenprincipe’. Als beide analisten hetzelfde constateren is daarmee de kous af, maar bij twijfel moet er nog een derde persoon naar kijken.
Infografiek over de VNT van in dit geval SARS-CoV-2 varianten (bron: WBVR).
Automatisch aflezen
Om het bewerkelijke aflezen te automatiseren en objectiever te maken, is vanuit diagnostiek twee jaar geleden het initiatief genomen om te investeren in een apparaat dat geautomatiseerde digitale imaging combineert met multi-mode detectie. Hiervoor is na een Europese aanbesteding de keuze gevallen op de door BioSPX geleverde Cytation 1 van Agilent. Dit met name vanwege de gebruiksvriendelijkheid, de duidelijke software en goede ondersteuning vanuit de leverancier. De combinatie met de BioStack, waarin maximaal 30 microtiterplaten kunnen worden gestapeld, maakt automatisering van omvangrijke imagingklussen mogelijk.
De mogelijkheid voor fluorescentie, die niet standaard op readers in deze klasse zit, was een must. “Sowieso hebben we fluorescentie nodig voor de opzet die we in gedachten hadden voor de virusdetectie voor het aflezen van de VNT’s. Maar deze detectietechniek kunnen we ook inzetten bij het bekijken van coupes en onderzoek aan organoids. Ook de optie voor live cell imaging zal menig onderzoeker aanspreken. Zo’n breed voor zowel diagnostiek als onderzoek toepasbaar apparaat is echt een boost voor de infrastructuur”, stelt Mirriam.
Groen licht
De grootschalige export van dieren brengt met zich dat er veel exportcertificaten moeten worden afgegeven. Hierin worden vaak verschillende soorten VNT’s geëist, waaronder bijvoorbeeld het equine arteritisvirus en het Schmallenbergvirus. “Bij beide virussen willen we met moleculair-biologische technieken een stukje gen inbouwen, dat codeert voor GFP, groenfluorescerend eiwit. In cellen waar het virus groeit detecteert de Cytation meer van dat groenfluorescerende licht. Net als bij het klassiek aflezen van de VNT’s geldt dat in epjes, waar groen licht te zien is, het virus heeft gezeten, en er dus geen antilichaam in het serum zat. Verschil met het handmatig aflezen is dat de Cytation automatisch middels de Gen5 software een plus- of min-score geeft en daar zelfs een handzaam rapportje van maakt. We hopen dit testconcept in de loop van dit jaar verder uit te werken, te valideren en certificeren. Al is het bij diagnostiek altijd lastig plannen in verband met mogelijke virusuitbraken, die dan terstond al onze aandacht vragen.”
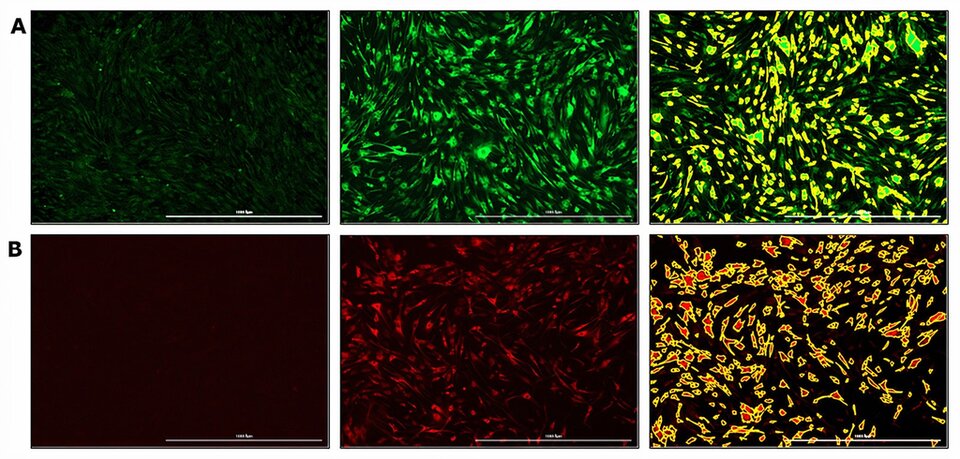
VNT-plaatjes
De Virus Neutralisatie Test (VNT) is de gouden standaard voor serologische detectie van het meten van neutraliserende antilichamen. De multifunctionele Bioreader, de Cytation-1 (BioTek), combineert geautomatiseerde microscopie met conventionele microtiterplaatdetectie. Daarmee is dit apparaat uitermate geschikt voor snelle, nauwkeurige en objectieve analyses binnen de Diagnostiek, zoals een VNT. Immunofluorescentiekleuring van een viraal eiwit, of het gebruik van virussen die een fluorescerend reporterconstruct tot expressie brengen, biedt hiervoor een robuust testformat. Momenteel wordt dit apparaat gebruikt om een innovatieve neutralisatietest voor het Bovine Viral Diarrhea Virus (BVDV) te ontwikkelen: (A-B) Fluorescerende kleuring van BVDV- en niet-geïnfecteerde embryonale rundertracheacellen (EBTr-cellen). (A) Kleuring met fluorescerende kleurstof GFP en (B) met fluorescerende kleurstof Cy5. Links: niet-geïnfecteerde cellen. Midden: BVDV geïnfecteerde cellen. Rechts: softwarematig gesegmenteerd beeld van de met BVDV geïnfecteerde cellen middels Gen5-beeldanalyse.
Het diermodel voorbij
De onderzoekers van WVBR weten de Cytation inmiddels goed te vinden. Zo ook Luca Bordes, die onderzoek doet aan het vogelgriepvirus. Doel van zijn promotie-onderzoek is om te herkennen wanneer bepaalde stammen gevaarlijker of minder gevaarlijk worden voor bepaalde diersoorten. “Dat kan je in diermodellen doen. Je infecteert een kip met een bepaalde stam en je kijkt hoe pathogeen die stam is voor dat dier. Het aantal verschillende stammen dat je kan testen in zo’n diermodel is echter beperkt; ten opzichte van wat er aan virussen rondgaat is dat peanuts. Door ex vivo of in vitro modellen te ontwikkelen kan je relatief gemakkelijk de range van te onderzoeken stammen uitbreiden. Bovendien kan je gerichter kijken naar de werking van een virus: hoe snel dat virus zich gaat vermenigvuldigen, hoe de immuunrespons verloopt of welke factoren bijdragen aan de verspreiding van het virus. Uiteindelijk –maar dat is nog verre toekomst die buiten de scope van mijn PhD-onderzoek ligt– hopen we op een punt te komen dat we het aantal dierproeven hiermee kunnen verminderen”, vertelt Luca enthousiast.
Uiteindelijk hopen we op een punt te komen dat we het aantal dierproeven hiermee kunnen verminderen.
Replicatiedynamiek
De experimenten van Luca op een 96-wells plaat zijn een variatie op het VNT-werk van diagnostiek. “We maken ook weer van die tienvoudige verdunningen, maar dan op een 96-wells plaat. De virussen infecteren cellen, die in de welletjes zitten. Als het virus zich heeft vermenigvuldigd, dan kan je dat detecteren. Normaal deden we dat met een enzymatische kleuring. Dan kreeg je een kleuromzetting en vervolgens moest je handmatig aflezen volgens het ‘vier-ogenprincipe’ per welletje om op een titer uit te komen. Nu kan dat sneller en betrouwbaarder met de Cytation. Zo kunnen we factoren die te maken hebben met de pathogeniciteit van een virus in kaart brengen, bijvoorbeeld de replicatie van dat virus. Kan een virus zich sneller repliceren op eendencellen dan op kippencellen? En hoe zit het met varkenscellen en humane cellen? Zo ontstaat er een patroon op verschillende celsoorten. Dat noemen we de replicatiedynamiek.”
Verder automatiseren
“Als je per plaat één meetpunt hebt, ben je nog steeds heel lang bezig”, vervolgt Luca zijn uitleg. “Daar komt die automatisering van pas. We hebben gekweekt op cellen afkomstig van verschillende species en hebben daar samples van genomen op verschillende tijdspunten. Dat hebben we uitgetitreerd op de verdunningsplaat en die lezen we af met de Cytation. In combinatie met de BioStack, die je met maximaal 30 microtiterplaten kunt vullen, hoef je daar niet meer naar om te kijken. De walk-away time is cruciaal om flink productie te kunnen draaien.”
Nog wel bewerkelijk is het om al die samples op de 96-wells platen uit te verdunnen. Je zou het liefst direct dat monster nemen en meteen weten hoeveel virusdeeltjes erin zitten. Of misschien zelfs in de plaat zelf al direct meten. “Daarvoor proberen we verschillende platen op een bepaald moment af te breken en te meten hoeveel positieve cellen daar in zitten. En zo kan je ook de toename berekenen. Met behulp van mathematische modellen kunnen we dan berekenen hoe die virussen aan het groeien zijn. En hoe snel ze schade aanbrengen aan de cellaag in het welletje. Zo bouwen we een dynamisch model van hoe die virussen groeien.”
Toegevoegde waarde
Door de testen snel en betrouwbaar uit te voeren en het ‘vier-ogenprincipe’ in te bouwen in een apparaat, dat altijd op dezelfde consequente manier de imagingbeelden interpreteert, liggen interessante toepassingen in het verschiet. “Je kunt bijvoorbeeld een risk assessment een stuk robuuster maken omdat je sneller en uitgebreider kunt screenen. Bijvoorbeeld door in enkele dagen voor 50 stammen de replicatiedynamiek bij verschillende celsoorten te testen. Iets wat nu praktisch gezien nog een bijna onhaalbare klus is”, stelt Luca.
En ook vaccinmakers kunnen hiervan profiteren. Zij produceren vaak ‘life attenuated’ of ‘inactivated’ vaccins op cellijnen. Dan is het interessant om te weten welke stam het snelste groeit op welke cellijn. “Uiteindelijk is de productie van een virus niet alleen afhankelijk van hoeveel deeltjes er worden geproduceerd, maar ook hoe snel die de cellen kapot maakt waarin het virus moet groeien. Een virus dat snel groeit, maar alle cellen binnen een dag kapot maakt, produceert minder virus dan een langzaam groeiend virus dat cellen tien dagen in leven houdt om zich te kunnen vermeerderen. Ook bij dit type onderzoek biedt de combinatie van geavanceerde apparatuur en onze expertise van diagnostiek en kennis van modelleren unieke mogelijkheden voor de toekomst als het gaat om het opsporen, bestrijden en voorkomen van dierziekten. Daar ligt de kracht van ons instituut”, besluit Mirriam.