
Rikst Vallinga, student Biologie en Medisch Laboratoriumonderzoek aan NHL Stenden Hogeschool, ontwikkelde voor de module Innovatieve Diagnostiek van het vernieuwde curriculum een qPCR instructiepracticum. Tweedejaars studenten gaan met behulp van twee recent door Hogeschool Van Hall Larenstein bij Westburg Life Sciences aangeschafte qTOWERiris qPCR-apparaten onderzoeken in hoeverre bepaalde genen meer of minder in expressie komen van HeLa-cellen die zijn blootgesteld aan waterstofperoxide.
Design based education brengt studenten intensiever in contact met het werkveld
Na in hun eerste jaar aan de hand van design based education aan het werk te zijn geweest met onder meer microbiologie, PCR en kloneren, gaan studenten van de opleidingen Biotechnologie en Biologie en Medisch Laboratoriumonderzoek in Leeuwarden het komende schooljaar ook als tweedejaars met de nieuwe onderwijsopzet aan de slag. Hierbij vinden theorie en praktijk elkaar in projecten, die zoveel mogelijk met partijen in het werkveld worden opgezet. In het tweede jaar komt onder andere qPCR aan bod, waarvoor studenten Rikst Vallinga en Twan Keizer in het kader van hun stageproject het instructiepracticum hebben ontwikkeld.

‘Tijdens mijn stage leer ik het meeste, want dan heb je een echt project’. Dat krijgen docenten, ook die van de opleidingen binnen ‘Life Sciences & Technology’ –een samenwerkingsverband tussen Hogeschool Van Hall Larenstein en NHL Stenden Hogeschool– vaak te horen. “In het klassieke curriculum zit het grootste deel van die ‘proof of the pudding’ in het laatste jaar, waarin studenten stage lopen bij onderzoeksinstituten of bedrijven en worden ondergedompeld in de praktijk. De eerste jaren staan vooral in het teken van het opdoen van theoretische kennis en het aanleren van praktische vaardigheden. Die zijn nog steeds onmisbaar –begrijp mij niet verkeerd!–, maar door het direct toepassen van die kennis en vaardigheden om een probleem op te lossen of iets uit te zoeken beklijven die beter, leren studenten er meer van. Dat onderwijsconcept van design based education rollen we momenteel gefaseerd uit bij onder meer de opleidingen Biotechnologie en Biologie en Medisch Laboratoriumonderzoek. Vorig jaar werden de eerstejaars studenten voor het eerst onderwezen volgens het vernieuwde curriculum, dat vanaf volgend schooljaar ook in het tweede jaar zal worden toegepast”, vertelt Wouter Suring, docent-onderzoeker aan NHL Stenden Hogeschool.

Twan Keizer, student Biotechnologie aan Hogeschool Van Hall Larenstein/NHL Stenden Hogeschool, zette een instructiepracticum op waarmee aan de hand van qPCR de stressreactie van een zandraket op zout groeimedium genetisch in kaart kan worden gebracht.
Neem een kijkje op de hogeschool via de promotiefilmpjes voor Biotechnologie en Biologie en Medisch Laboratoriumonderzoek.
Dichtbij het werkveld
Met de nieuwe opzet staat in elk van de vier periodes in een studiejaar een project rondom een bepaald thema centraal. In het eerste jaar beginnen de studenten met het leren van de basis van de microbiologie, gevolgd door PCR en monoklonale productie. Het jaar wordt afgesloten met een multidisciplinair project waarin verschillende opleidingen vanuit hun eigen expertise meewerken aan een oplossing op het gebied van bijvoorbeeld medische diagnostiek, bodemmicrobiologie of plantenbiotechnologie. In het tweede jaar zijn die thema’s –zoals in het hele curriculum– gebaseerd op relevante maatschappelijke uitdagingen, bijvoorbeeld rondom bioplastics en geneesmiddelenontwikkeling. Hierbij maken studenten gebruik van essentiële technieken zoals celkweek, data science en qPCR.
In de loop van de studie neemt de omvang en de complexiteit van de projecten toe. De benodigde labvaardigheden en theoretische kennis voor een project worden in de betreffende periode aangeleerd. Vaak is er voorafgaand aan het onderzoeksproject nog een wat nauwer afgebakende praktijkopdracht –een instructiepracticum–, waarin de studenten met het geleerde aan de slag gaan. Met de ervaringen die ze daarmee opdoen hebben ze voldoende bagage om een probleem/vraag uit het werkveld op te lossen.
Maximaal vier studenten werken groepsgewijs aan een project, maar dat kunnen er ook drie, twee of zelfs één zijn. Het kan zijn dat meerdere van die groepjes aan dezelfde opdracht werken, maar dan is elk van die groepen met een andere invalshoek bezig; heeft bijvoorbeeld een andere target.
“Het is de bedoeling om de projecten zoveel mogelijk samen te doen met partijen in het werkveld; een onderzoeksinstituut of bedrijf. Het voordeel voor de studenten is dat ze al in het begin van hun studie nauw in contact komen met het werkveld, en zo een goede indruk kunnen krijgen van de diversiteit aan mogelijkheden die er na hun studie op hen ligt te wachten. Dat gebeurt overigens niet alleen via deze mini-stages. Zo geven mensen uit het werkveld colleges en organiseren we een excursie naar één of meer spelers in he werkveld”, vertelt Wouter.
qPCR
De vierde periode van het tweede jaar staat bij het nieuwe curriculum in het teken van qPCR. De ontwikkeling van het instructiepracticum hiervoor is gedaan door twee ‘oude-curriculum’ studenten in het kader van hun 20-weken stage, aan het einde van het tweede studiejaar. Rikst Vallinga deed dit voor de opleiding Biologie en Medisch Laboratoriumonderzoek; Twan Keizer voor Biotechnologie. Op het compliment dat het heel knap is om pas opgedane kennis om te zetten in een haalbaar en werkend protocol en daarbij niet meer degene te zijn die uitvoert, maar die zegt hoe het moet, wordt met typisch Friese nuchterheid gereageerd: “Omdat we begin van dit schooljaar de module qPCR hadden zaten de theorie en de praktijk nog vers in het geheugen. Het was gemakkelijk om dit weer op te pakken. Bovendien werden we best wel intensief begeleid door onze docenten, onder andere middels een wekelijks voortgangsgesprekje”, aldus Rikst.

Blik in één van de practicumlokalen waarin naast Rikst en Twan twee medestudenten poseren en achterin in het midden docent-onderzoeker Wouter Suring te zien is.
Liever geen cactus
Het practicum van Twan staat in het teken van de invloed van groeiomstandigheden op de genexpressie van een plant. Hiervoor is hij gestart met het selecteren van een geschikt modelorganisme. “De plant moet bijvoorbeeld snel en gemakkelijk kunnen worden gekweekt, dus niet een of andere cactus, die bij 53 °C moet groeien. Daarnaast moet er al in de literatuur zijn gedocumenteerd dat bepaalde omstandigheden een effect op de genexpressie hebben; je gaat de studenten niet iets laten onderzoeken waarvan je niet zeker weet of dat een resultaat oplevert! Ik ben uitgekomen bij dezandraket (Arabidopsis thaliana), die onder invloed van zout, dat je toevoegt aan de voedingsoplossing, een stressreactie geeft, die de vorming van zuurstofradicalen tegengaat, zodat er geen of minder schade aan de plant ontstaat vanwege die zoutstress. Die reactie wordt gereguleerd via de alternatieve ademhalingsroute, die afwijktvan de normale route voor de energievoorziening van de plant. De alternatieve route is minder effectief, maar zorgt er wel voor dat de schade beperkt blijft.”
Door het meten van de genexpressie (welke genen komen tot expressie, en in welke mate?) kan je de invloed van zoutstress op de alternatieve ademhalingsroute bepalen. Om dit goed in te passen in een qPCR-protocol heeft Twan eerst een plan van aanpak gemaakt en aan de hand daarvan de meest geschikte kits en primers besteld. Vervolgens heeft hij het uitgedachte protocol doorlopen om te controleren of alles loopt zoals het moet lopen. Zo heeft hij na de RNA-isolatie een gelelektroforese uitgevoerd om de kwaliteit van het geïsoleerde RNA te controleren. Daarna heeft hij er via reverse transcriptase PCR cDNA van gemaakt, dat kan worden ingezet in het qPCR-apparaat. Analyse van de data uit de qPCR-run geeft inzicht in welke genen specifiek omhoog of omlaag gaan in expressie en geven zo een beeld van de invloed van zoutstress.
HeLa-cellen
Waar het kweken van de zandraketten de nodige tijd kost, is het wat dat betreft een stuk handiger werken met de HeLa-cellen, die Rikst gebruikt voor het qPCR-instructiepracticum voor Biologie en Medisch Laboratoriumonderzoek. Deze humane baarmoederhalskankercellen, die veel worden gebruikt voor biomedisch onderzoek, zijn namelijk binnen 24 uur gekweekt. De opzet van het door haar ontwikkelde practicum volgt in grote lijnen die van Twan. Ook hier wordt een stressor toegevoegd, in dit geval waterstofperoxide, die er voor zorgt dat bepaalde genen meer of minder tot expressie komen. Ook in dit practicum wordt het RNA geïsoleerd en omgezet in cDNA. Vervolgens gaan de studenten met een qPCR de specifieke genen amplificeren en analyseren.
We gaan altijd voor het nieuwste van het nieuwste.
Voor het eggie
Waar in de instructiepractica nog veel wordt voorgeschreven (dat organisme, deze omstandigheden, dit protocol) gaan de studenten daarna in overleg met een opdrachtgever in een project zelf een bepaald target kiezen, dat is gekoppeld aan een onderzoeksvraag. “Ze hebben de techniek dan al eigen gemaakt, maar nu moeten ze hetzelfde trucje in combinatie met de theoretische kennis toepassen om hun probleemstelling op te lossen. Voor het uitvoeren van hun experimenten reserveren de studenten labtijd; in de regel hebben ze daar vier dagdelen in evenveel weken voor nodig. Op het lab is begeleiding aanwezig, maar het is wel de bedoeling dat ze goed voorbereid het lab opgaan, dat ze precies weten wat ze willen en wat ze gaan inzetten. Om dat te borgen hebben we een go/no-go moment ingebouwd, waarbij al dan niet een akkoord wordt gegeven op een plan van aanpak. De voorbereiding, het nadenken over hoe en waarom je een experiment inricht, is minstens zo belangrijk als de uitvoering”, vertelt docent Xavier Gallego y van Seijen, die Rikst heeft begeleid bij het opzetten van het instructiepracticum met de HeLa-cellen.
Nieuwste van het nieuwste
Waar Rikst en Twan hun qPCR’s nog hebben uitgevoerd op de bestaande PCR-apparatuur, kunnen de studenten vanaf het komende studiejaar gebruik maken van twee door Westburg Life Sciences geleverde qTOWERiris qPCR-apparaten van Analytik Jena. Aanleiding voor deze investering is dat de oudere apparaten niet meer kunnen worden gerepareerd. Je kunt eenvoudigweg niet het risico nemen dat ze tijdens een practicum uitvallen.
Voor de hogeschool was dit een uitgelezen kans om voor een kerntechniek als qPCR de laatste stand der techniek in huis te halen. “We gaan altijd voor het nieuwste van het nieuwste. Apparaten gaan bij ons best wel lang mee, want we gebruiken ze veel minder intensief dan bijvoorbeeld routinelabs. Als je een gloednieuw apparaat koopt, kan je langer uitgaan van ondersteuning en software updates”, stelt Xavier.
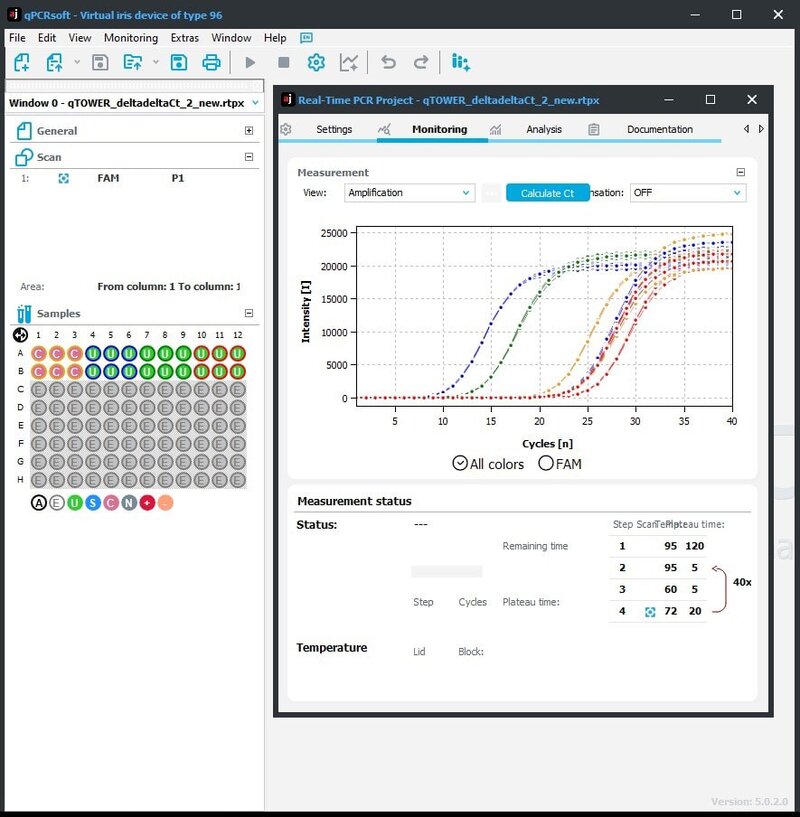
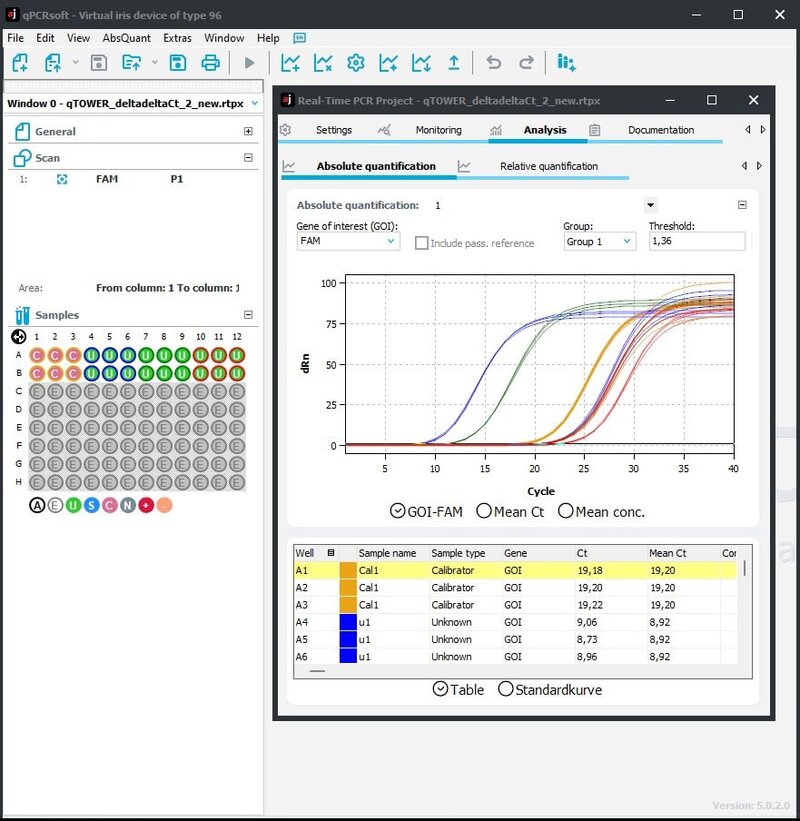
Screenshots van de vernieuwde interface van de qPCRsoft 5. Bovenaan zijn de interactieve knoppen te zien die van toepassing zijn op de functie waar je mee bezig bent. Links overzicht van de opzet, de samples en kleuren die gemeten worden. Het plaatje links laat de ruwe data met het protocol en samples in een overzicht zien. Rechts is een scherm afgebeeld met een overzicht van de Ct per sample, dat met één klik is te exporteren.
Snel mee aan de slag
Voor de praktijkdocenten zijn belangrijke criteria dat de apparatuur robuust is en dat je er gemakkelijk mee kunt werken. “Als een student per ongeluk iets verkeerd doet, wil je niet dat er iets kapot gaat”, zegt praktijkdocent Linda van Genne. “De apparatuur moet ook makkelijk te bedienen en in te stellen zijn. Je hebt als student beperkte tijd om een techniek aan te leren en je kunt geen routine opbouwen, zoals dat later in het werkveld wel het geval is. Het is dus zaak dat studenten snel begrijpen hoe het werkt en dat ze zelf problemen kunnen oplossen.”
Als we voor iedere student een licentie zouden moeten aanschaffen, gaat dat behoorlijk in de papieren lopen.
Licentievrije software
De keuze voor de qTOWERiris is ook ingegeven door de licentievrije software. “Als we voor iedere student een licentie zouden moeten aanschaffen, gaat dat behoorlijk in de papieren lopen. Nu kan elke student de software downloaden en gebruiken op zijn of haar eigen laptop, zodat de hele data-analyse op een eigen laptop uitgevoerd kan worden. De software is zeer intuïtief en daarmee heel toegankelijk voor studenten. In de basis zijn er natuurlijk veel overeenkomsten in de software van de verschillende fabrikanten. Wij leren het onze studenten aan met deze software. Als ze op stage met een apparaat van een andere fabrikant moeten werken, herkennen ze snel hoe de software in elkaar zit en kunnen ze er zo mee uit de voeten”, aldus Linda.
Duurzaam blijven innoveren
Met de vervanging van drie qPCR’s door twee nieuwe wordt niet alleen ruimte op de labtafel gewonnen, maar blijven de opleidingen ook werken met de nieuwste apparatuur die energiezuiniger is. Wouter: ”In het geval van de twee nieuwe qPCR’s slaan we wat dat betreft een flinke slag. We gaan zonder in te boeten op qPCR-capaciteit van drie (twee 48- en één 96-wells) naar twee 96-wells apparaten, die bovendien een stuk sneller zijn. Maar waar we voorheen aan iedere qPCR een computer hadden hangen voor de bediening kunnen we de twee qTOWER’s met één computer bedienen. We gaan dus van zes naar drie apparaten. We vinden het belangrijk om te blijven kijken hoe we zo efficiënt mogelijk met stroomverbruik om kunnen gaan, thuis zet je de koelkast ook uit als je op vakantie gaat. Met deze nieuwe investering kunnen de opleidingen Biologie en Medisch Laboratoriumonderzoek en Biotechnologie in Leeuwarden in ieder geval weer jaren vooruit.”